- VIPULS
- Comité Ético Científico
Comité Ético Científico
En concordancia con la responsabilidad social de la Universidad de La Serena ante la comunidad regional, constituyó en el año 2008 el primer Comité de Ética y Bioética de la Corporación. En respuesta a los cambios que se han producido en el proceso de actualización de la legislación que regula estas acciones, se ha creado oficialmente este año el nuevo Comité Ético-Científico de la Universidad para abordar las interrelaciones entre la generación de conocimiento y la protección de las personas, animales y del medio ambiente, derivados de las investigaciones realizadas bajo el amparo o patrocinio de nuestra Institución.
En tal contexto y a modo de invitación para revisar los diferentes aspectos y compromisos que se exponen más adelante, esta legislación de carácter obligatoria hace referencia a los derechos de las personas que participan voluntariamente en las investigaciones y al cuidado de los datos sensibles en resguardo de su identidad y confidencialidad mediante compromisos de autorización bajo consentimiento informado.
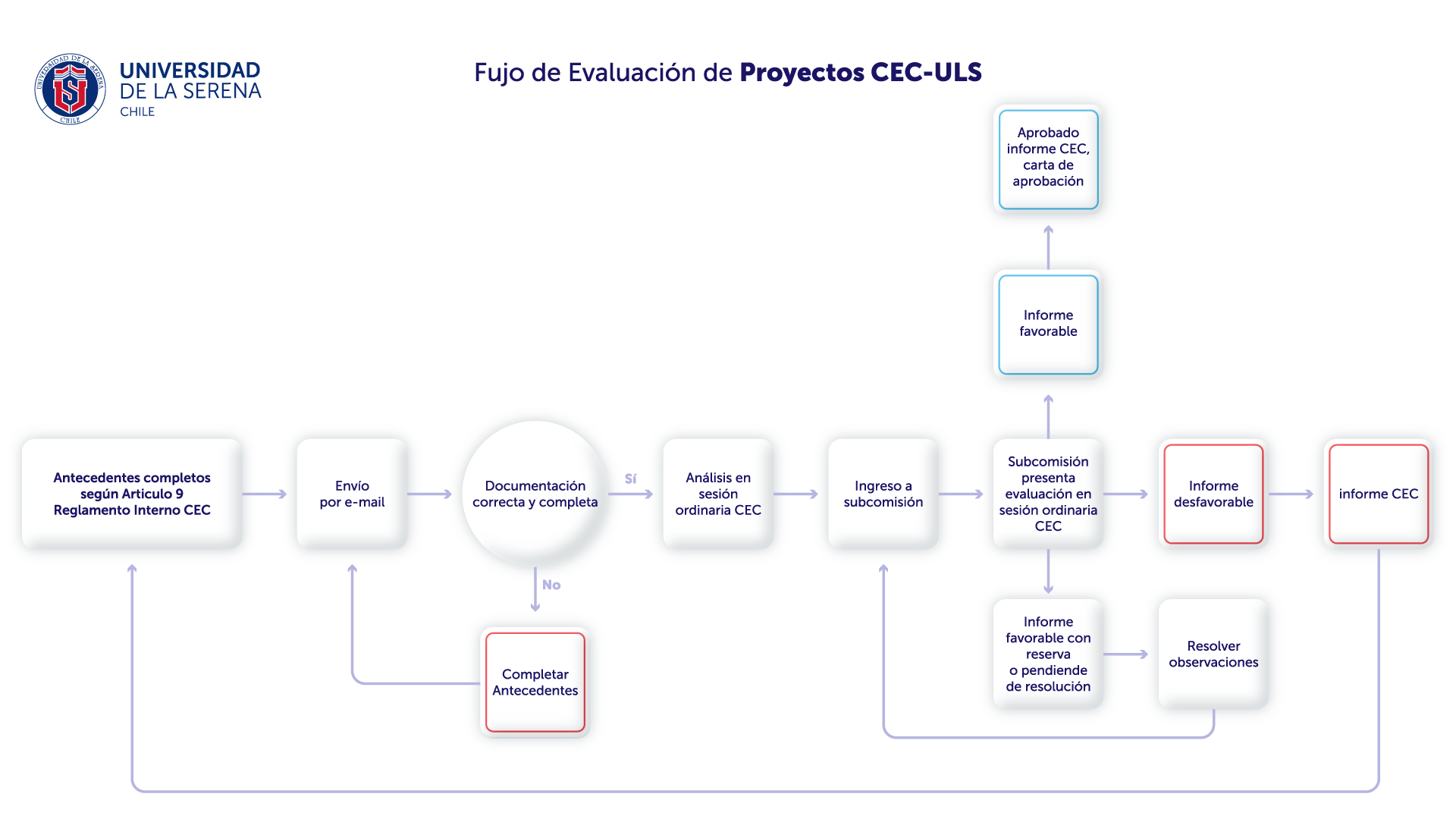
Cada proyecto de investigación deberá ser presentado por el investigador responsable a la Secretaría del Comité mediante envío electrónico al correo eticauls@userena.cl
El comité dará respuesta al investigador dentro de 45 días hábiles, a partir de la recepción de la documentación enviada, siempre y cuando el protocolo de investigación cumpla con los requisitos y documentación que se señalan a continuación:
- Una copia del proyecto completo versión impresa y otra copia digital (CD o Email) (por pandemia no se reciben documentos impresos, solo digitales).
- Formato completo específico para la solicitud de revisión (Protocolo respectivo).
- Consentimiento informado y/o asentimiento informado cuando se requiera.
- Curriculum vitae de los investigadores que no estén incluido en el protocolo de investigación, acompañado de las respectivas certificaciones.
- Manual del investigador, el que es requisito para ser presentado al comité cuando se trate de un ensayo clínico (ver Protocolo guía del ISP en anexos).
- Carta de compromisos del investigador responsable de informar resultados de la evaluación y estados de avances comprometidos cuando sean requeridos por el Comité.
- Seguros asociados o comprometidos de existir.
- Otros antecedentes que sean considerados relevantes para la toma de razón del comité.
- Los documentos presentados no serán devueltos.
- Miembros
- Normativas
- Declaraciones
- Pautas de Evaluación
- Memorias
- Reglamento y Protocolos
El Comité estará constituido por dos representantes de cada Facultad (titular y suplente), en ausencia o inhabilidad del titular, el suplente asumirá sus funciones y serán nombrados por el Decano de la Facultad adscrita. Entre los miembros del Comité se establecerá las funciones de Presidente y Vicepresidente, además existirá un académico que cumplirá funciones de Secretaria (o) Ejecutiva (o) del Comité, un licenciado en leyes o abogado/a, un representante de la comunidad y un experto en bioética.
| Nombre | Cargo | Facultad | |
|---|---|---|---|
| Amelia Rosa Herrera Lavanchy | Presidente Comité | Facultad de Ciencias Sociales, Empresariales y Jurídicas | aherrera@userena.cl |
| Mauricio Iván González Arias (S) | Vicepresidente Comité | Facultad de Humanidades | mgonzale@userena.cl |
| Andrés Felipe Bianchetti Saavedra | Secretario Ejecutivo | abianchetti@userena.cl | |
| Lina Rosa Barrientos Pacheco | Representante de la Comunidad | linabarri@gmail.com | |
| Elizabeth Aida Escobar Toro | Abogada | eliescobar@userena.cl | |
| Francisco Fernando Roco Godoy | Representante | Facultad de Humanidades | froco@userena.cl |
| Carlos Arturo Navarrete Rojas | Representante | Facultad de Ciencias | cnavarrete@userena.cl |
| Jorge Humberto Núñez Cobo | Representante | Facultad de Ingeniería | jhnunez@userena.cl |
| Christian Esteban Merino Álvarez (S) | Representante | Facultad de Ciencias Sociales, Empresariales y Jurídicas | cmerino@userena.cl |
| Luis Carlos Castillo Barahona (S) | Representante | Facultad de Ciencias | lcastillo@userena.cl |
| Alexander Alfonso Álvarez (S) | Representante | Facultad de Ingeniería | alexander.alfonso@userena.cl |
Ley-20120
Pautas-Autoevaluación-CEC
Reglamento CEC Diario Oficial
Estándares de Acreditación CEC
Confidencialidad y Conflicto de interés
Acceso a datos de fichas clínicas
Consentimiento en una investigación científica
Ley 19.628 Sobre la protección de la vida privada
Ley 20.120 Sobre la investigación científica en el ser humano, su genoma, y prohíbe la clonación humana
Decreto 114 aprueba reglamento de la Ley Nº 20.120, sobre la investigación científica en el ser humano, su genoma, y prohíbe la clonación humana
Decreto 30 modifica decreto N° 114, de 2010, que aprueba reglamento de la Ley n° 20.120, sobre la investigación científica en el ser humano, su genoma y prohíbe la clonación humana
Ley 20.584 regula los derechos y deberes que tienen las personas en relación con acciones vinculadas a su atención en salud
Normas éticas del PSI (Programa de subvenciones para la Investigación) de la OPS (Organización panamericana de la Salud) para Investigación con sujetos humanos
Decreto Supremo N° 23 del 2012 del Ministerio de Salud. Reglamento de Ley 20.584 del 12 de junio 2012
Ley 20.850 Modificación al código sanitario. Crea un sistema de protección financiera para diagnósticos y tratamientos de alto costo y rinde homenaje póstumo a don Luis Ricarte Soto Gallegos
Marcos Normativos en ética de la investigación científica con seres vivos, 2007
Norma técnica Nº 57 Regulación de la ejecución de Ensayos clínicos que utilizan Productos farmacéuticos en seres Humanos
Circular N°A15/01/2016 Minsal – ISP, que difunde las Pautas de autoevaluación para el proceso de acreditación de los CEC, complementada por circular A15/46 del 25 de octubre del 2013
Resolución exenta N° 1176 del 07 agosto 2001 que modifica Resolución Exenta 96 aprueba arancel de acciones de protección de la; salud
Resolución 183 Exenta modifica Resolución nº 403 Exenta, de fecha 11 de julio de 2013, del Ministerio de Salud y mediante la cual se aprobó la norma general técnica Nº 151 sobre estándares de acreditación de los comité ético científicos
“Aspectos Bioéticos de la Experimentación Animal”
Aspectos Bioéticos en Experimentación CONICYT
Principios Éticos en personas (Emanuel)
Ética en Personas con Discapacidad
Derechos del Niño/Niña
Memoria Anual Comité Ético Científico Año 2017
Memoria Anual Comité Ético Científico Año 2018
Memoria Anual Comité Ético Científico Año 2019
Memoria Anual Comité Ético Científico Año 2020
Asentimiento
Carta Compromiso Investigador
Compromiso de Confidencialidad
Declaración de Intereses
Manual del Investigador ISP
Pauta informes de avance y seguimiento
Recomendaciones CI
Reglamento: Comité Ético-Científico Universidad de La Serena
Formulario Carta de Compromiso Investigador
Protocolo Agentes Biológicos
Protocolo Agentes Tóxicos
Protocolo Animales
Protocolo Personas